細胞間接着装置と上皮恒常性
「細胞間接着をつくる・守る・操る」をキーワードに細胞間接着装置による上皮恒常性の維持機構の解明を目指しています
"Making, Maintaining, Manipulating Cell Junctions"
We are interested in the roles of cell-cell junctions in regulating epithelial homeostasis.
細胞間接着装置の構築機構とその生理的役割の解明
Making cell-cell junctions
私たちのからだは数十兆個もの細胞から成り立っています。これらの細胞は互いに接着することにより組織やからだを作っています。私たちは、細胞同士を接着させる細胞間接着装置に着目し、その構築機構の解明に取り組んでいます。
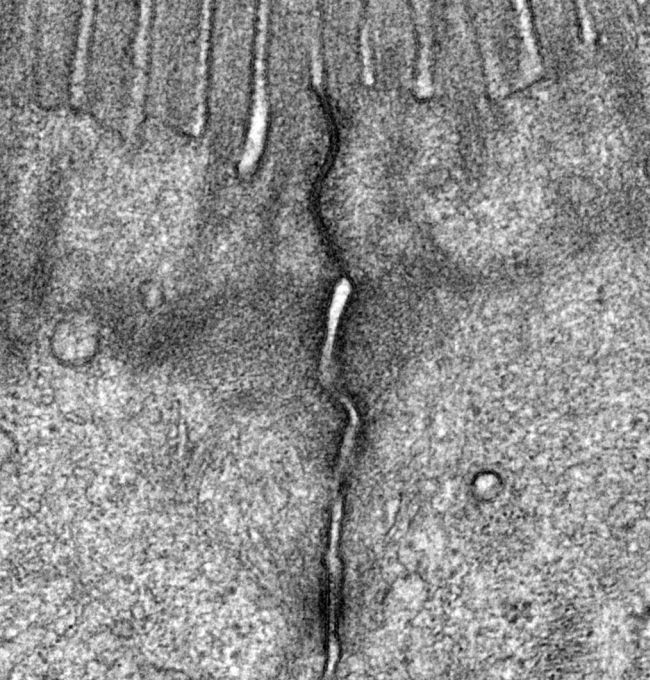
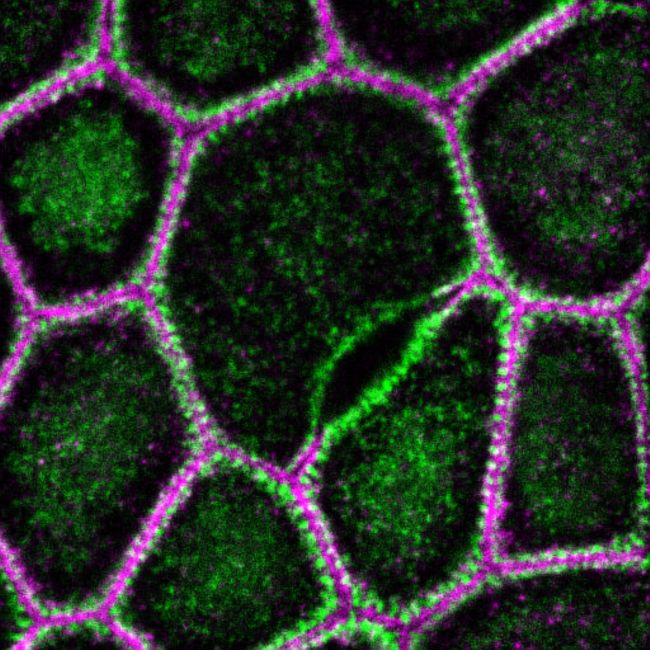
上皮細胞の接着複合体は密着結合(TJ)、接着結合(AJ)、デスモソームの3つの接着構造から成り立っています。私たちはこれらの細胞間接着装置がどのように成熟・分化するかをゲノム編集や光学顕微鏡・電子顕微鏡を用いたイメージングを用いて研究しています。これまでにゲノム編集を用いて細胞間接着装置の構成因子の体系的な機能破壊を行ってきました。その結果、Claudin・JAM-A・CARといった密着結合の膜タンパク質が協調的に密着結合の構造と機能を制御することを明らかにしてきました(Otani et al., J Cell Biol, 2019; Nguyen et al., J Cell Biol, 2024)。
また、これらの細胞間接着装置の構成因子のノックアウト細胞の表現型の解析を通して、これまでに明らかにされてこなかった細胞間接着装置の新たな生理機能の解明にも取り組んでいます。
Our bodies consist of trillions of cells. These cells adhere to each other to make up our body. We focus on cell-cell junctions to understand how cells cooperate to build multicellular organisms.
The junctional complex of epithelial cells consists of three adhesion structures: tight junctions (TJs), adherens junctions (AJs), and desmosomes. We study how these cell-cell junctions form using genome editing and light/electron microscopy.
We have systematically interrogated the function of the molecular constituents of the cell-cell junctions and have shown that TJ membrane proteins such as Claudin, JAM-A, and CAR coordinately regulate the structure and function of TJs (Otani et al., J Cell Biol, 2019; Nguyen et al., J Cell Biol, 2024).
By analyzing these knockout cells, we are exploring the molecular organization and physiological functions of cell-cell junctions.
上皮恒常性の維持機構の解明
Maintaining cell-cell junctions
上皮組織は体を守るバリアとして働く大事な組織です。しかし、上皮が体の表面を覆うということは、上皮が外環境の様々なストレスに常に晒されることを意味します。このようなストレスは時として上皮のバリアを破綻させます。上皮細胞がどのようにしてバリアの破綻を防ぐのか、またバリアが破綻してしまったときに、どのようにそれを検出し修復するのか。私たちは上皮の恒常性を保つ仕組みの解明に取り組んでいます。
私たちはゲノム編集により密着結合を特異的かつ完全に欠く細胞を作出し、密着結合が上皮細胞の力抵抗性に重要な役割を果たすことを初めて明らかにしました(Nguyen et al., J Cell Biol, 2024)。現在、密着結合がどのようにして力抵抗性を制御するのかを、メカノセンサー分子ZO-1に着目して研究しています。
1970年代にMorataらはMinute変異細胞が正常細胞に取り囲まれた時に排除される現象を見出し、これを細胞競合と呼びました。私たちは、細胞競合を細胞間相互作用により上皮恒常性を保つ仕組みと考え、細胞競合が上皮バリアの恒常性維持に果たす役割、また細胞競合における細胞間接着装置の役割に注目して研究を進めています。
Epithelia acts as a barrier to protect the internal body from the external environment. However, as epithelia cover the body surface, they are constantly exposed to various environmental stresses, sometimes leading to epithelial barrier breakage. How do epithelial cells prevent barrier breakage, and how do they detect and repair barrier defects to maintain homeostasis? We are investigating the mechanisms that control epithelial homeostasis.
By analyzing TJ membrane proteins-deficient cells, we have demonstrated that TJs are essential for the force resistance of epithelial cells(Nguyen et al., J Cell Biol, 2024). We are investigating how TJs regulate mechanical resistance, focusing on the mechanosensor molecule ZO-1.
In the 1970s, Morata and colleagues found that Minute mutant cells were excluded from the tissue when surrounded by normal cells and named the phenomenon "cell competition." Cell competition maintains tissue homeostasis through cell-cell interactions. We are interested in the roles of cell competition in epithelial barrier homeostasis and the functions of cell-cell junctions in regulating cell competition.
細胞間接着の操作技術の開発
Manipulating cell-cell junctions
"What I cannot create, I do not understand" (Richard Feynman)
これまでの研究により、細胞間接着装置の分子構成の理解が進みました。しかし、私たちは細胞間接着装置の設計原理をどこまで理解しているのでしょうか?私たちは細胞間接着を人為的に操作する技術を開発し、また合成生物学により人工的な細胞間接着を創ることにより、細胞間接着の設計原理に迫りたいと考えています。
そのために、私たちは現在光遺伝学を用いて細胞間接着分子の活性を制御する技術の開発を進めています。また、合成生物学的な手法により人工的な細胞間接着を設計することにより、細胞同士の接着を定量的に自由自在に操ることを可能にし、細胞同士が接着がするための最小要素は何か、細胞間接着の設計原理を解明したいと考えています。これらの技術を用いて細胞間接着を定量的かつ予測可能な形で操作することにより、細胞間接着が上皮細胞などの多細胞ダイナミクスに与える影響を解明します。
Our understanding of the molecular architecture of cell-cell adhesion has greatly advanced. But to what extent do we understand the design principles of cell-cell adhesion? We want to understand the design principles of cell-cell adhesion by developing techniques to manipulate cell-cell adhesion and by creating artificial cell-cell adhesion by synthetic biology.
We are developing techniques to control the activity of intercellular adhesion molecules using optogenetics. We are also designing artificial intercellular adhesion using synthetic biology techniques, enabling us to manipulate cell-cell adhesion quantitatively in a predictable manner and to elucidate the design principles of intercellular adhesion. Using these techniques, we will explore the impact of cell-cell adhesion on the dynamics of multicellular systems.