神経分子機能研究室
人が美しい景色や音楽に感動したり、楽しかったことを覚えていたり、新しい概念を創り出したりするのは、脳内の神経細胞ネットワークによって担われています。この脳の神経細胞は、体内の他の細胞と違って、生涯入れ替わらず、脳の持ち主の個体と一緒に年を取っていきます。アルツハイマー病などの疾患により神経細胞が死んでしまうと、認知症などが引き起こされます。どうすれば、加齢による神経細胞の機能低下や、疾患リスクの増加を防ぎ、脳の機能を生涯にわたって維持できるでしょう?
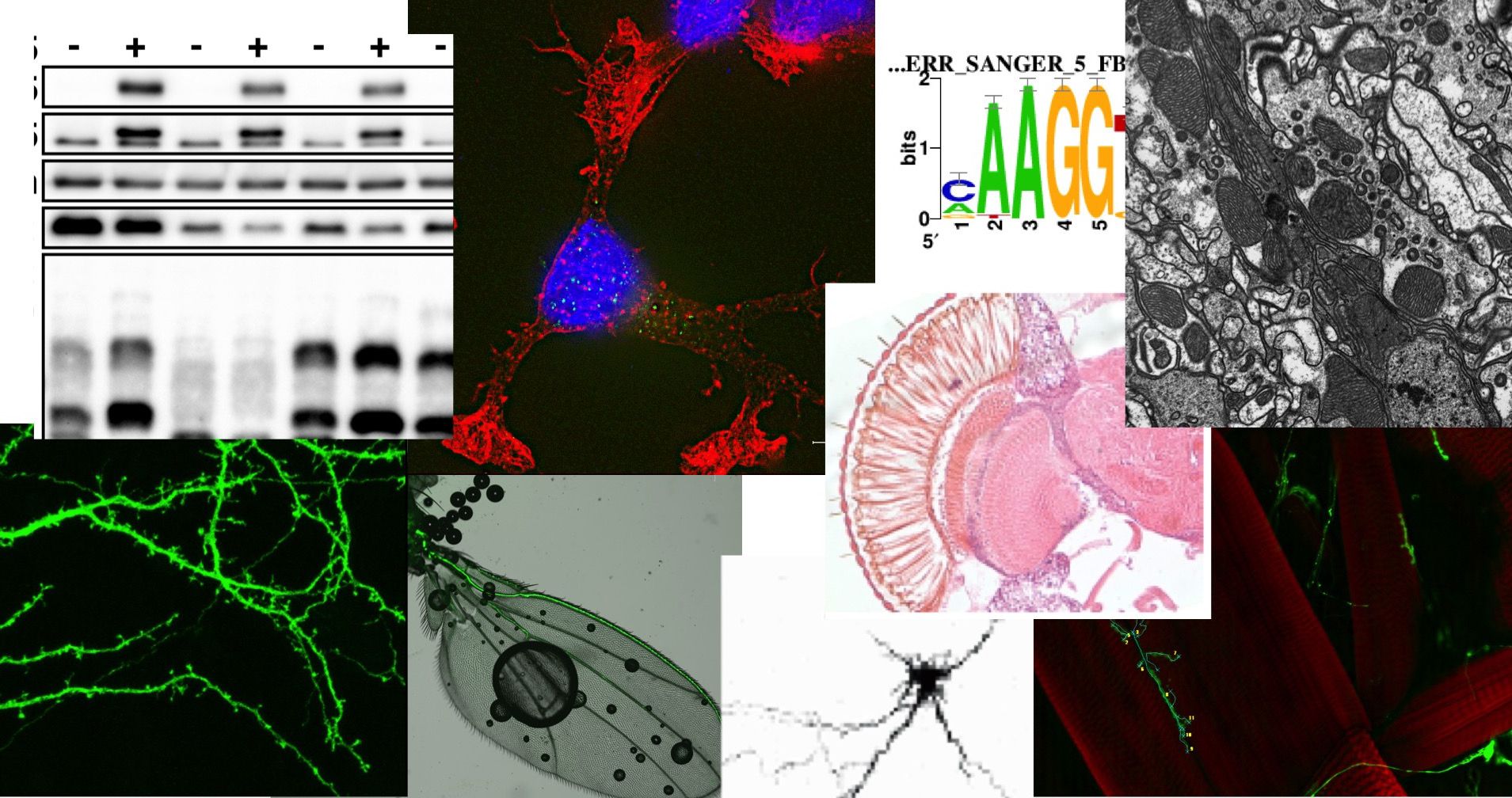
私たちは、この問いについて、分子生物学、細胞生物学、ショウジョウバエ疾患モデル、イメージング、行動解析、遺伝子発現解析など、様々な手法を駆使して研究しています。
私たちの研究の成果は、脳の機能や老化という複雑な生命現象の理解に役立ち、また将来の予防・治療法の開発にも役立つと期待されます。
熱意のある大学院生を募集します。詳しくはメールでお問い合わせください。
現在のテーマ
1. 摂食と細胞内エネルギー代謝に注目した脳アンチエイジング
2. アルツハイマー病など加齢依存性神経変性疾患の発症メカニズム
3. 脳老化と疾患におけるミトコンドリアの役割
安藤の2014以前の発表論文等についてはこちら:
http://scholar.google.co.jp/citations?user=aUQ_Q5EAAAAJ&hl=en
所属教員
研究内容 1
摂食と細胞内エネルギー代謝に注目した脳アンチエイジング
加齢によって、記憶力などの認知機能は低下しますが、神経細胞のどのような変化が記憶力低下の引き金となるのでしょう。私たちは、脳の神経細胞のエネルギー代謝が加齢によって変化することに注目して、脳の老化を抑える方法を探しています。また、カロリー制限は寿命を伸ばす効果が知られていますが、食事と脳神経細胞における糖代謝が老化にどのように関わるかについても調べています。
最近の論文のプレスリリースはこちら:
https://www.tmu.ac.jp/news/topics/30590.html
研究内容 2
アルツハイマー病など加齢依存性神経変性疾患の発症メカニズム
アルツハイマー病など、老年期に発症する神経変性疾患には、その発症や進行のメカニズムには不明な点が多く、その根本的な治療法は現在のところありません。タウと呼ばれるタンパク質は、これらの疾患の脳で蓄積し、神経細胞死を引き起こすと考えられています。タウは、通常は軸索で微小管の安定性を制御しています。しかし、疾患脳では、タウは正常脳と異なるリン酸化などの修飾をうけ、構造変化をおこして蓄積しています。私たちは、疾患脳でタウの変化を引き起こす分子メカニズムを明らかにし、それに基づいてタウによる神経細胞死を緩和する戦略を見出すことを目指しています。
最近の論文のプレスリリースはこちら:https://www.tmu.ac.jp/news/topics/30417.html
https://www.tmu.ac.jp/news/topics/31066.html
研究内容 3
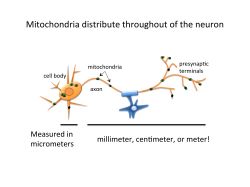
脳老化と疾患におけるミトコンドリアの役割
ミトコンドリアは細胞内エネルギー供給の大部分を担い、また、核酸合成、脂質、鉄、尿素の代謝、シグナリングなど、重要な機能をもちます。脳の神経細胞は、エネルギーを多く必要とするだけでなく、情報伝達のために長く伸ばした突起(軸索)をもっているため、ミトコンドリアを必要な場所に分布させることも必要です。ミトコンドリアの異常によるミトコンドリア病では神経症状がみられ、また老年性の神経変性疾患の発症にもミトコンドリアの異常が関わる可能性があります。わたしたちは、ミトコンドリアの加齢による変化と、脳の老化や神経変性疾患のリスクの増加との関係を調べています。また、ミトコンドリアの賦活によって、ミトコンドリア病にともなう症状や老化による脳機能低下が緩和できるかを研究しています。
研究室のモットー
Collaboration makes happy lab and good science
©2020 Department of Biological Sciences, Tokyo Metropolitan University