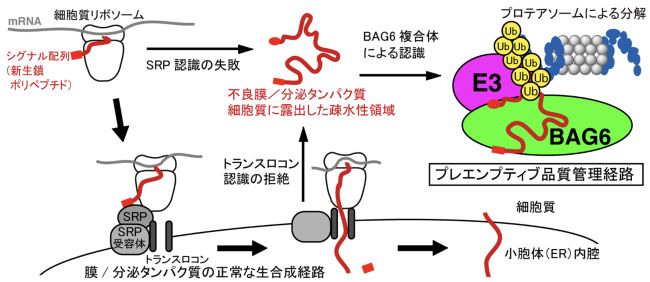
1. Hagiwara, T., Minami, R., Ushio, C., Yokota, N., and Kawahara, H. (2023) Proteotoxic stresses stimulates dissociation of UBL4A from the tail-anchored protein recognition complex.
Biochem. J. (London), doi: 10.1042/BCJ20230267(本研究室の大学院生による論文)
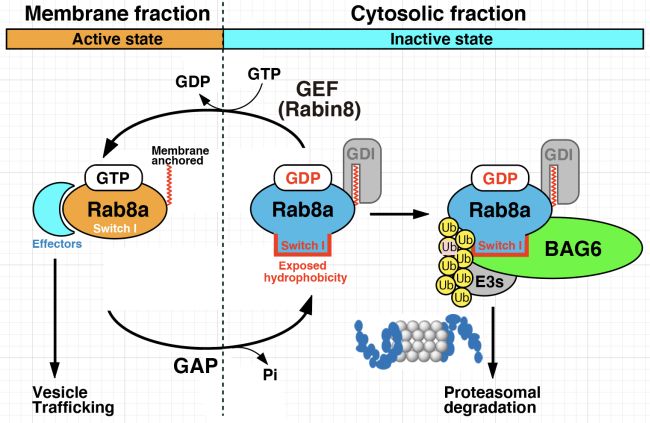
2. Takahashi, T., Shirai, J., Matsuda, M., Nakanaga, S., Matsushita, S., Wakita, K., Hayashishita, M., Suzuki, R., Noguchi, A., Yokota, N., and Kawahara, H. (2023) Protein quality control machinery supports primary ciliogenesis by eliminating GDP-bound Rab8-family
GTPases.
iScience, 26: doi.org/10.1016/j.isci.2023.106652(全著者は本研究室の教員・大学院生)
3. Miyauchi, M., Matsumura, R., and Kawahara, H. (2023) BAG6 supports stress fiber formation by preventing the ubiquitin-mediated degradation of RhoA.
Mol. Biol. Cell. 34: doi: 10.1091/mbc.E22-08-0355.(本研究室の大学院生による論文)
4. Matsuura, Y., Noguchi, A., Yokota, N., and Kawahara, H. (2020) Nuclear accumulation of ZFP36L1 is cell cycle-dependent and determined by a C-terminal serine-rich cluster.
J. Biochem. 168, 477-489.(本研究室の大学院生による論文)
5. Mimami, S., Yokota, N., and Kawahara, H. (2020) BAG6 contributes glucose uptake by supporting the cell surface translocation of the glucose transporter GLUT4.
Biol. Open. 9, bio047324.(本研究室の大学院生による論文)
6. Takahashi, T., Minami, S., Tajima, K., Tsuchiya, Y., Sakai, N., Suga, K., Hisanaga, S., Obayashi, N., Fukuda, M., and Kawahara, H. (2019) Cytoplasmic control of Rab-family small GTPases through BAG6.
EMBO Rep. 20: e46794.(本研究室の大学院生による論文)
7. Kamikubo, K., Kato, H., Kioka, H., Yamazaki, S., Tsukamoto, O., Nishida, Y., Asano, Y., Imamura, H., Kawahara, H., Shintani, Y., and Takashima, S. (2019) A molecular triage process mediated by RING finger protein 126 and BCL2-associated athanogene 6 regulates degradation of G0/G1 switch gene 2.
J. Biol. Chem. 294, 14562-14573.
8. Hayashishita, M., Kawahara, H., and Yokota N. (2019) BAG6 deficiency induces mis-distribution of mitochondrial clusters under depolarization.
FEBS Open Bio. 9, 1281-1291.(本研究室の大学院生による論文)
9. Demizu, S., Asaka, M., Kawahara, H. and Sasaki, E. (2019) TAS-203, an oral phosphodiesterase 4 inhibitor, suppresses goblet cell hyperplasia and MUC5AC production in rodent models.
Eur. J. Pharmacol. 849, 22-29.(本研究室の大学院生による論文)
10. Noguchi, A., Adachi, S., Yokota, N., Hatta, T., Natsume, T., and Kawahara, H. (2018) ZFP36L2 is a cell cycle-regulated CCCH-protein necessary for DNA lesion-induced S-phase arrest.
Biol. Open 7, bio031575.(本研究室の大学院生による論文)
11. Kondo, M., Noguchi, A., Matsuura, Y., Shimada, M., Yokota, N., and Kawahara, H. (2018) Novel phosphorelay-dependent control of ZFP36L1 protein during the cell cycle.
Biochem. Biophys. Res. Comm. 501; 387-393.(本研究室の大学院生による論文)
12. Xuan, X., Matsumoto, S., Endo, S., Fukushima, A., Kawahara, H., Saeki, Y., and Komada, M. (2018) Deubiquitinases USP5 and USP13 are recruited to and regulate heat-induced stress granules by deubiquitinating activities.
J. Cell Sci. 131, 1-11. doi: 10.1242/jcs.210856.
13. Yamamoto, K., Hayashishita, M., Minami, S., Suzuki, K., Hagiwara, T., Noguchi, A., and Kawahara, H. (2017) Elimination of a signal-sequence uncleaved form of defective HLA protein through BAG6.
Sci. Rep. 7, DOI:10.1038/s41598-017-14975-9(本研究室の大学院生による論文)
14. Suzuki, R. and Kawahara, H. (2016) UBQLN4 recognizes mislocalized transmembrane domain proteins and targets these to proteasomal degradation.
EMBO Rep. 17, 842–857.(本研究室の大学院生による論文)
15. Tanaka, H., Takahashi, T., Xie, Y., Minami, R., Yanagi, Y., Hayashishita, M., Suzuki, R., Yokota, N., Shimada, M., Mizushima, T., Kuwabara, N., Kato, R., and Kawahara, H. (2016) A conserved island of BAG6/Scythe is related to ubiquitin domains and participates in short hydrophobicity recognition.
FEBS J. 283, 662–677.(本研究室の大学院生による論文)
16. Takasugi, T., Saito, T., Asada, A., Kawahara, H. and Hisanaga, S.-I. (2016) Two degradation pathways of the p35 Cdk5 activation subunit, dependent and independent of ubiquitination.
J. Biol. Chem. 291, 4649-4657. doi: 10.1074/jbc.M115.692871
17. Yamaki, Y., Kagawa, H., Hatta, T., Natsume, T., and Kawahara, H. (2016) The C-terminal cytoplasmic tail of hedgehog receptor Patched1 is a platform for E3 ubiquitin ligase complexes.
Mol. Cell. Biochem. 414: 1-12.(本研究室の大学院生による論文)
18. Kuwabara, N., Minami, R., Yokota, N., Matsumoto, H., Senda, T., Kawahara, H. (co-corresponding author), and Kato, R. (2015) Structure of a BAG6 (Bcl-2-associated athanogene 6)-Ubl4a (ubiquitin-like protein 4a) complex reveals a novel binding interface that functions in tail-anchored protein biogenesis.
J. Biol. Chem. 290, 9387-9398.(本研究室の大学院生による論文)
19. Kawahara, H., Minami, R. and Yokota, N. (2013)
JB Review: BAG6/BAT3: Emerging roles in quality control for nascent polypeptides.
J. Biochem. 153, 147-160. (全著者は本研究室の教員・大学院生)
20. Kagawa, H., Shino, Y., Kobayashi, D., Demizu, S., Shimada. M., Ariga, H. and Kawahara, H. (2011) A novel signaling pathway mediated by the nuclear targeting of C-terminal fragments of mammalian Patched 1.
PLoS ONE 6: e18638.(本研究室の大学院生による論文)
21. Sato, K., Minegishi, S., Takano, J., Plattner, F., Saito, T., Asada, A., Kawahara, H., Iwata, N., Saido, T.C., and Hisanaga, S. (2011) Calpastatin, an endogenous calpain-inhibitor protein, regulates the cleavage of the Cdk5 activator p35 to p25.
J. Neurochem. 117:504-515.
22. Minami, R., Hayakawa, A., Kagawa, H., Yanagi, Y., Yokosawa, H. and Kawahara, H. (2010) BAG-6 is essential for selective elimination of defective proteasomal substrates.
J. Cell Biol. 190: 637-650.(本研究室の大学院生による論文)
23. Ojima, K., Y Kawabata, Y., Nakao, H., Nakao, K., Doi, N., Kitamura, F., Ono, Y., Hata, S., Suzuki, H., Kawahara, H., Labeit, S., Toyama-Sorimachi, N., Suzuki, K., Maeda, T., Abe, K., Aiba, A., and Sorimachi, H. (2010) Role of dynamic distribution of muscle-specific calpain in physical-stress adaptation and muscular dystrophy in mice.
J. Clin. Invest. 120: 2672–2683.
24. Shimada, M., Kanematsu, K., Tanaka, K., Yokosawa, H. and Kawahara, H. (2006) Proteasomal ubiquitin receptor RPN-10 controls sex determination in Caenorhabditis elegans.
Mol. Biol. Cell 17: 5356-5371.
25. 川原 裕之 (2021)
「プレエンプティブ品質管理を介した不良タンパク質のサーベイランスとその意義」
月刊「細胞」ニューサイエンス社
26. 川原 裕之、南 雪也、宮内 真帆、高橋 俊樹 (2020)
「ミニレヴュー:プレエンプティブ品質管理を介した膜タンパク質の選択的分解機構」
生化学 第92巻第2号, pp.1-6.(本研究室の大学院生による論文)
27. 川原裕之(2018)
「膜/分泌タンパク質の生合成プロセスを監視するプレエンプティブ品質管理」
医学のあゆみ
29.川原裕之(2015)「ユビキチンによるタンパク質品質管理と疾患」
The World of UBIQUITIN Vol. 3
30. 川原裕之, 南亮介 (2011)「BAG6を介したタンパク質品質管理の新機構」
実験医学、第29巻、7月増刊号「細胞内のリノベーション機構:タンパク質分解系による生体制御」(村田茂穂,反町洋之編), 羊土社(本研究室の大学院生による論文)